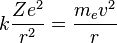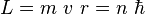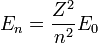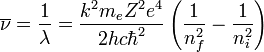jueves, 22 de septiembre de 2011
Modelo atómico de Chadwick.
(Descubrimiento del neutrón)
En 1932 un físico inglés, James Chadwick, confirmó la existencia de otra partícula subatómica de la que se tenían múltiples sospechas: el neutrón. Los neutrones son partículas subatómicas que no tienen carga eléctrica, y cuya masa es casi igual a la de los protones.
El neutrón es una partícula subatómica que no tiene carga eléctrica. Su masa es casi igual a la del protón.
Chadwik determinó mediante el estudio de reacciones nucleares la masa del Neutrón, el cual no posee carga (Por eso le llamaron Neutrón) siendo ésta de: mn = 1.6750 x 10-24 g
n = neutrón
miércoles, 21 de septiembre de 2011
Modelos atómicos!
| Historia: modelos atómicos |
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles. Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración. | ||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||
lunes, 19 de septiembre de 2011
Modelo Atomico de Bohr
El modelo atómico de Bohr es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados (ver abajo). Fue propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos (dos problemas que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905.
Bohr se basó en el átomo de hidrógeno para realizar el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.
En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, o la órbita más cercana posible al núcleo. El electromagnetismo clásico predecía que una partícula cargada moviéndose de forma circular emitiría energía por lo que los electrones deberían colapsar sobre el núcleo en breves instantes de tiempo. Para superar este problema Bohr supuso que los electrones solamente se podían mover en órbitas específicas, cada una de las cuales caracterizada por su nivel energético. Cada órbita puede entonces identificarse mediante un número entero n que toma valores desde 1 en adelante. Este número "n" recibe el nombre de Número Cuántico Principal.
Bohr supuso además que el momento angular de cada electrón estaba cuantizado y sólo podía variar en fracciones enteras de la constante de Planck. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno.
Estos niveles en un principio estaban clasificados por letras que empezaban en la "K" y terminaban en la "Q". Posteriormente los niveles electrónicos se ordenaron por números. Cada órbita tiene electrones con distintos niveles de energía obtenida que después se tiene que liberar y por esa razón el electrón va saltando de una órbita a otra hasta llegar a una que tenga el espacio y nivel adecuado, dependiendo de la energía que posea, para liberarse sin problema y de nuevo volver a su órbita de origen.
Sin embargo no explicaba el espectro de estructura fina que podría ser explicado algunos años más tarde gracias al modelo atómico de Sommerfeld. Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitiría a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica.
En 1913, Niels Bohr desarrolló su célebre modelo atómico de acuerdo a tres postulados fundamentales:
Primer postulado
Los electrones describen órbitas circulares en torno al núcleo del átomo sin radiar energía.
La causa de que el electrón no radie energía en su órbita es, de momento, un postulado, ya que según la electrodinámica clásica un carga en movimiento acelerado debe emitir energía en forma de radiación.
Para conseguir el equilibrio en la órbita circular, las dos fuerzas que siente el electrón: la fuerza coulombiana, atractiva, por la presencia del núcleo y la fuerza centrífuga, repulsiva por tratarse de un sistema no inercial, deben ser iguales en módulo en toda la órbita. Esto nos da la siguiente expresión:
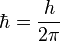 . Esta condición matemáticamente se escribe:
. Esta condición matemáticamente se escribe:
Se puede demostrar que este conjunto de hipótesis corresponde a la hipótesis de que los electrones estables orbitando un átomo están descritos por funciones de onda estacionarias. Un modelo atómico es una representación que describe las partes que tiene un átomo y como están dispuestas para formar un todo. Basándose en la constante de Planck consiguió cuantizar las órbitas observando las líneas del espectro.
consiguió cuantizar las órbitas observando las líneas del espectro.
Bohr se basó en el átomo de hidrógeno para realizar el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.
En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, o la órbita más cercana posible al núcleo. El electromagnetismo clásico predecía que una partícula cargada moviéndose de forma circular emitiría energía por lo que los electrones deberían colapsar sobre el núcleo en breves instantes de tiempo. Para superar este problema Bohr supuso que los electrones solamente se podían mover en órbitas específicas, cada una de las cuales caracterizada por su nivel energético. Cada órbita puede entonces identificarse mediante un número entero n que toma valores desde 1 en adelante. Este número "n" recibe el nombre de Número Cuántico Principal.
Bohr supuso además que el momento angular de cada electrón estaba cuantizado y sólo podía variar en fracciones enteras de la constante de Planck. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno.
Estos niveles en un principio estaban clasificados por letras que empezaban en la "K" y terminaban en la "Q". Posteriormente los niveles electrónicos se ordenaron por números. Cada órbita tiene electrones con distintos niveles de energía obtenida que después se tiene que liberar y por esa razón el electrón va saltando de una órbita a otra hasta llegar a una que tenga el espacio y nivel adecuado, dependiendo de la energía que posea, para liberarse sin problema y de nuevo volver a su órbita de origen.
Sin embargo no explicaba el espectro de estructura fina que podría ser explicado algunos años más tarde gracias al modelo atómico de Sommerfeld. Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitiría a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica.
En 1913, Niels Bohr desarrolló su célebre modelo atómico de acuerdo a tres postulados fundamentales:
Primer postulado
Los electrones describen órbitas circulares en torno al núcleo del átomo sin radiar energía.
La causa de que el electrón no radie energía en su órbita es, de momento, un postulado, ya que según la electrodinámica clásica un carga en movimiento acelerado debe emitir energía en forma de radiación.
Para conseguir el equilibrio en la órbita circular, las dos fuerzas que siente el electrón: la fuerza coulombiana, atractiva, por la presencia del núcleo y la fuerza centrífuga, repulsiva por tratarse de un sistema no inercial, deben ser iguales en módulo en toda la órbita. Esto nos da la siguiente expresión:
- Donde el primer término es la fuerza eléctrica o de Coulomb, y el segundo es la fuerza centrífuga; k es la constante de la fuerza de Coulomb, Z es el número atómico del átomo, e es la carga del electrón, me es la masa del electrón, v es la velocidad del electrón en la órbita y r el radio de la órbita.
Y ahora con ésta ecuación y sabiendo que la energía total es la suma de las energías cinética y potencial:
- Donde queda expresada la energía de una órbita circular para el electrón en función del radio de dicha órbita.
Segundo postulado
No todas las órbitas para electrón están permitidas, tan solo se puede encontrar en órbitas cuyo radio cumpla que el momento angular, L, del electrón sea un múltiplo entero de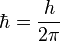 . Esta condición matemáticamente se escribe:
. Esta condición matemáticamente se escribe:- con
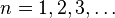
- con
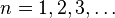 ; subíndice introducido en esta expresión para resaltar que el radio ahora es una magnitud discreta, a diferencia de lo que decía el primer postulado.
; subíndice introducido en esta expresión para resaltar que el radio ahora es una magnitud discreta, a diferencia de lo que decía el primer postulado.
- expresando el resultado en ångström.
Igual que antes, para el átomo de Hidrógeno (Z=1) y el primer nivel permitido (n=1), obtenemos:
- que es la llamada energía del estado fundamental del átomo de Hidrógeno.
Tercer postulado
El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles. Este fotón, según la ley de Planck tiene una energía:- donde ni identifica la órbita inicial y nf la final, y ν es la frecuencia.
A veces, en vez de la frecuencia se suele dar la inversa de la longitud de onda:
Ésta última expresión fue muy bien recibida porque explicaba teóricamente la formula fenomenológica hallada antes por Balmer para describir las líneas observadas desde finales del siglo XIX en la desexcitación del Hidrógeno, que venían dadas por:
- con
 , y donde RH es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso nf = 2, es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg (1.097107m − 1), coincide con el valor de la formula teórica.
, y donde RH es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso nf = 2, es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg (1.097107m − 1), coincide con el valor de la formula teórica.
Se puede demostrar que este conjunto de hipótesis corresponde a la hipótesis de que los electrones estables orbitando un átomo están descritos por funciones de onda estacionarias. Un modelo atómico es una representación que describe las partes que tiene un átomo y como están dispuestas para formar un todo. Basándose en la constante de Planck
 consiguió cuantizar las órbitas observando las líneas del espectro.
consiguió cuantizar las órbitas observando las líneas del espectro.
sábado, 17 de septiembre de 2011
John Dalton
•Alrededor de 1803 ganó gran aceptación la teoría de un científico inglés llamado Dalton, la cual decía que la naturaleza de la materia y la forma en que los elementos se combinaban, sugería la existencia de un límite hasta el cual un elemento se podía subdividir.
•A principios del siglo XIX y retomando la explicación propuesta por Demócrito, Dalton, en su teoría atómica, estudió los átomos y utilizó símbolos para representar su combinación; usaba círculos negros para los átomos de Carbono; los círculos blancos indicaban los átomos de oxígeno y uno negro junto a otro blanco era el monóxido de carbono. Además al mismo tiempo en que formuló su teoría, publicó una tabla de masas atómicasen la que asignó a la masa de 1 al H, el átomo más ligero de todos.
•Los postulados de Dalton proporcionan una base del trabajo, por ello se le conoce como el padre de la teoría atómica Moderna.
•A continuación se enuncian dichos postulados:
1.- Los elementos estan formados por partículas muy pequeñas, separadas, indivisibles e indestructibles, llamados átomos.
2.- Los átomos de un mismo elemento son idénticos y poseen las mismas propiedades físicas y químicas, pero son diferentes de los átomos de otros elementos. Por ejemplo: los átomos de plata (Ag)son idénticos entre sí; por tanto, tienen las mismas propiedades, pero si se comparan con los átomos de sodio (Na) éstos tienen diferentes propiedades.
3.- Los compuestos químicos se forman al unirse átomos de dos o más elementos diferentes: por ejemplo el agua, se obtiene de la unión de dos átomos de hidrógeno y uno de oxígeno.
4.- Al combinarse los átomos de dos mismos elementos para fomar una serie de compuestos lo hacen en una relación sencilla de número enterios. Por ejemplo: en el agua y agua oxigena H2O -------> H2O2, la relación es de 2 a 1 y de 2 a 2 respectivamente.
De acuerdo con los postulados de Dalton crea su modelo atómico en el cual el átomo se considera una esfera sólida, maciza, pequeña, indivisible y de peso fijo.

Modelos atómicos
Los seres humanos somos únicos, originales e irrepetibles. Pertenecemos a una gran familia porque, a pesar de ser diferentes, nos parecemos.
El conocimiento actual que tenemos del átomo es el resultado de un gran esfuerzo los científicos a través del tiempo. Los grandes avances tecnológicos con que contamos en el mundo moderno, surgieron de las investigaciones sobre cómo esta compuesta la materia; las partículas que las constituyen y en ir descubriendo sus diferentes propiedades al reaccionar con otras sustancias, sin perder de vista tener un sano equilibrio, cuidado y desarrollo cin el ambiente que nos rodea.
•Gran parte de las actividades en nuestro planeta dependen de la electricidad, la mayor parte de ésta se despalza de un sitio a otro por medio de alambres de cobre. Ahora supongamos que tomamos una muestra del elemento y la dividimos en pedazos cada vez más pequeños.
•Los primeros modelos atómicos fueron los siguientes:
•Alrededor del año 400 a.C dos hombres griegos postularon lo siguiente:
•Leucipo: Planteó que la materia por muy pequeña que sea, siempre es capaz de dividirse en trozos cada vez más pequeños hasta que ya no se puedan dividir.

•Demócrito: Llamó átomos (sin división) a la partículas de menor tamaño posible. Además supuso que los átomos de cada elemento eran diferentes en tamaño y forma, razón por la cual le asignaba a los elementos propiedades distintas y también que una sustancia podía transformarse en otra alterando la naturaleza de la mezcla.
•Las ideas de Demócrito no fueron aceptadas en su tiempo, pero sí dos mil años después; su teoría perduró en los poemas de Epicuro y Lucrecio Caro.
•Es interesante mencionar la renovación que estos pensamientos implican y resaltar que los filósofos griegos se basaban en la observación y no en la experimientación para emitir sus teorías.
miércoles, 7 de septiembre de 2011
Nanociencia
La nanociencia es el estudio de los sistemas cuyo tamaño es de unos pocos (10-100) nanometros. Un nanómetro (nm) es 10 -9 metros, alrededor de 10 átomos de hidrógeno. Un leucocito tiene alrededor de 100.000 nm de diámetro. La nanociencia trata de comprender qué pasa a estas escalas, y la nanotecnología busca manipularlo y controlarlo. Lo que lleva a que la nanotecnologia sea un gran avance en diversos campos de la ciencias.
La Nanociencia es un área emergente de de la ciencia que se ocupa del estudio de los materiales de muy pequeñas dimensiones.
* Esto es: 1 nanometro = 0,000000001 metros.
* Es decir, un nanometro es la mil millonésima parte de un metro, o millonésima parte de un milímetro.
* También: 1 milímetro = 1.000.000 nanometros.
Hay varias razones por las que la Nanociencia se ha convertido en un importante campo científico con entidad propia. Una es la disponibilidad de nuevos instrumentos capaces de "ver" y "tocar" a esta escala dimensional. A principios de los ochenta fue inventado en Suiza (IBM-Zurich) uno de los microscopios capaz de "ver" átomos. Unos pocos años más tarde el Atomic Force Microscope fue inventado incrementando las capacidades y tipos de materiales que podían ser investigados... En la actualidad hay un gran número de instrumentos que ayudan a los científicos en el reino de lo nano. .
En respuesta a estas nuevas posibilidades los científicos han tomado conciencia de potencial futuro de la actividad investigadora en estos campos. La mayor parte de los países han institucionalizado iniciativas para promover la nanociencia y la nanotecnología, en sus universidades y laboratorios. Con los recientes aumentos en los fondos destinados a este tipo de investigación muchos científicos están llevando a cabo programas de investigación y la cantidad de descubrimientos y avances científicos se han incrementado de forma muy importante.
La Nanociencia es un área emergente de de la ciencia que se ocupa del estudio de los materiales de muy pequeñas dimensiones.
* Esto es: 1 nanometro = 0,000000001 metros.
* Es decir, un nanometro es la mil millonésima parte de un metro, o millonésima parte de un milímetro.
* También: 1 milímetro = 1.000.000 nanometros.
Hay varias razones por las que la Nanociencia se ha convertido en un importante campo científico con entidad propia. Una es la disponibilidad de nuevos instrumentos capaces de "ver" y "tocar" a esta escala dimensional. A principios de los ochenta fue inventado en Suiza (IBM-Zurich) uno de los microscopios capaz de "ver" átomos. Unos pocos años más tarde el Atomic Force Microscope fue inventado incrementando las capacidades y tipos de materiales que podían ser investigados... En la actualidad hay un gran número de instrumentos que ayudan a los científicos en el reino de lo nano. .
En respuesta a estas nuevas posibilidades los científicos han tomado conciencia de potencial futuro de la actividad investigadora en estos campos. La mayor parte de los países han institucionalizado iniciativas para promover la nanociencia y la nanotecnología, en sus universidades y laboratorios. Con los recientes aumentos en los fondos destinados a este tipo de investigación muchos científicos están llevando a cabo programas de investigación y la cantidad de descubrimientos y avances científicos se han incrementado de forma muy importante.
Número de Avogadro
El número de Avogadro puede definirse como la cantidad de entidades elementales (átomos, electrones, iones, moléculas) que existen en un mol de cualquier sustancia. Veamos qué es esto.
 El mol es la unidad del Sistema Internacional de Unidades que permite expresar una cantidad de sustancia. Se trata de la unidad que utilizan los químicos para expresar el peso de los átomos, que equivale a un número muy grande de partículas. Un mol equivale al número de átomos que hay en doce gramos de carbono-12 puro. La ecuación sería la siguiente: 1 mol = 6,022045 x 10 elevado a 23 partículas.Dicha cantidad suele redondearse como 6,022 x 10 elevado a 23 y recibe el nombre de número de Avogadro o constante de Avogadro, en honor al científico italiano Amedeo Avogadro (1776-1856), quien también formuló la ley que afirma que volúmenes iguales de gases distintos, bajo las mismas condiciones de presión y temperatura, contienen igual número de partículas. La utilidad de la constante de Avogadro radica en la necesidad de contar partículas o entidades microscópicas a partir de medidas macroscópicas (como la masa).
El mol es la unidad del Sistema Internacional de Unidades que permite expresar una cantidad de sustancia. Se trata de la unidad que utilizan los químicos para expresar el peso de los átomos, que equivale a un número muy grande de partículas. Un mol equivale al número de átomos que hay en doce gramos de carbono-12 puro. La ecuación sería la siguiente: 1 mol = 6,022045 x 10 elevado a 23 partículas.Dicha cantidad suele redondearse como 6,022 x 10 elevado a 23 y recibe el nombre de número de Avogadro o constante de Avogadro, en honor al científico italiano Amedeo Avogadro (1776-1856), quien también formuló la ley que afirma que volúmenes iguales de gases distintos, bajo las mismas condiciones de presión y temperatura, contienen igual número de partículas. La utilidad de la constante de Avogadro radica en la necesidad de contar partículas o entidades microscópicas a partir de medidas macroscópicas (como la masa).
 El mol es la unidad del Sistema Internacional de Unidades que permite expresar una cantidad de sustancia. Se trata de la unidad que utilizan los químicos para expresar el peso de los átomos, que equivale a un número muy grande de partículas. Un mol equivale al número de átomos que hay en doce gramos de carbono-12 puro. La ecuación sería la siguiente: 1 mol = 6,022045 x 10 elevado a 23 partículas.
El mol es la unidad del Sistema Internacional de Unidades que permite expresar una cantidad de sustancia. Se trata de la unidad que utilizan los químicos para expresar el peso de los átomos, que equivale a un número muy grande de partículas. Un mol equivale al número de átomos que hay en doce gramos de carbono-12 puro. La ecuación sería la siguiente: 1 mol = 6,022045 x 10 elevado a 23 partículas.Es importante tener en cuenta que el número de Avogadro es inmenso: equivale, por ejemplo, a todo el volumen de la Luna dividido en bolas de 1 milímetro de radio.
El número de Avogadro, por otra parte, permite establecer conversiones entre el gramo y la unidad de masa atómica.
Como el mol expresa el número de átomos que hay en 12 gramos de carbono-12, es posible afirmar que la masa en gramos de un mol de átomos de un elemento es igual al peso atómico en unidades de masa atómica de dicho elemento.
Suscribirse a:
Entradas (Atom)